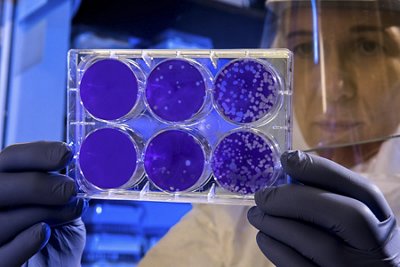
Importance de la précision : direction le contrôle qualité des produits biologiques
Par la rédaction de bioMérieux | Temps de lecture : 3 min
DATE DE PUBLICATION : 27 MARS 2024
L'homme utilise depuis des milliers d'années des produits dérivés des plantes et des animaux (produits biologiques) pour traiter les maladies mais, grâce à la naissance de la production de masse au 20e siècle, les produits biologiques sont devenus une classe reconnue de médicaments.
Contrairement aux médicaments d'origine chimique qui combinent des composants précis dans le cadre d'un processus ordonné, les produits biologiques sont généralement des molécules ou des mélanges de molécules complexes et de très grande taille, difficiles à caractériser.
Ces dernières années, les produits biologiques ont permis de mettre au point de nouvelles approches thérapeutiques et de transformer les résultats dans toute une série de domaines thérapeutiques. Citons parmi les principaux exemples de produits biologiques :
- les vaccins, utilisés pour induire une réponse immunitaire qui offre une protection contre les infections ou les maladies.
- les protéines thérapeutiques, versions génétiquement modifiées de protéines naturellement présentes dans l'organisme, comme l'insuline. Elles peuvent être utilisées pour remplacer une protéine anormale ou défectueuse et peuvent apporter à l'organisme une plus grande quantité d'une protéine en particulier afin de réduire les effets d'une maladie ou d'un traitement.
- les anticorps monoclonaux, type de protéine thérapeutique conçue pour servir d'anticorps de substitution pouvant restaurer, améliorer, modifier ou imiter l'attaque du système immunitaire contre les cellules indésirables, comme les cellules cancéreuses.
- les facteurs de croissance qui stimulent les processus cellulaires susceptibles de favoriser la réparation et la régénération tissulaire.
- les immunomodulateurs qui agissent en stimulant ou en inhibant le système immunitaire et peuvent aider l'organisme à lutter contre les cancers, les infections ou d'autres maladies.
- d'autres produits dérivés du sang et du plasma humains offrent toute une gamme de fonctions et sont prescrits pour de nombreuses maladies différentes : facteurs de la coagulation, immunoglobines, albumine et inhibiteurs de protéase.
Garantir la qualité dans la production de produits biologiques
Le contrôle qualité est un domaine d'activité essentiel de l'industrie pharmaceutique, il contribue à garantir l'efficacité des produits thérapeutiques, à assurer leur homogénéité d'un lot à l'autre et, en fin de compte, à assurer la sécurité des patients. La nature même des produits thérapeutiques biologiques exige une démarche intransigeante en matière de surveillance et de contrôle qualité. La production de produits biologiques met en jeu des systèmes vivants complexes qui peuvent réagir fortement aux changements les plus minimes de leur processus et de leur environnement de fabrication. Des écarts mineurs peuvent modifier considérablement les caractéristiques du produit biologique final et avoir des répercussions sur son fonctionnement après son administration au patient.
Un autre aspect essentiel est la préservation de la stérilité car de nombreux produits thérapeutiques biologiques sont administrés directement dans la circulation sanguine. La contamination peut emprunter de nombreuses voies : matières premières initiales utilisées (par exemple, les cellules, les compléments), surfaces des équipements, personnes assurant les processus de fabrication et le transfert de matériaux dans un processus de production aseptique ou à partir de ce processus. En outre, en raison de l'utilisation de matières premières sensibles comme les cultures cellulaires, les produits biologiques sont plus sensibles aux contaminants que les autres produits.
La comparaison entre les vaccins sur culture cellulaire et les vaccins à ARNm permet d'illustrer ce principe : la production de vaccins sur culture cellulaire repose sur des processus biologiques, ce qui nécessite des tests de contrôle qualité supplémentaires destinés à détecter rapidement les bactéries susceptibles d'infecter les cellules du vaccin, comme les mycoplasmes par exemple. En revanche, les vaccins à ARNm sont obtenus par des procédés de synthèse et, s'ils peuvent être contaminés par d'autres voies, les problèmes comme la contamination par des mycoplasmes ne se posent pas, du fait de l'absence de cellules à infecter.
En partie en raison de leur nature unique, le développement des produits biologiques en tant que classe thérapeutique a contraint les organismes chargés de la réglementation à évoluer et à adapter leurs approches en matière de catégorisation et de réglementation. En 1992, l'Organisation Mondiale de la Santé (OMS) a publié pour la première fois ses Bonnes pratiques de fabrication pour les produits biologiques. Depuis cette date, l'OMS s'est appuyée sur l'expérience collective qu'elle a acquise en matière de produits biologiques pour élaborer un ensemble de normes réglementaires mondiales qui fixent des exigences minimales pour l'agrément de tous les médicaments biologiques. (1)
En outre, l'Agence européenne des médicaments a élaboré des principes directeurs scientifiques détaillés concernant les médicaments biologiques afin de soutenir le dépôt de nouvelles demandes d'autorisation de mise sur le marché pour les médicaments biologiques. (2) La Food and Drug Administration américaine a également reconnu l'importance croissante des médicaments biologiques et a mis en place une procédure d'agrément simplifiée pour les produits biologiques. (3)
Une approche fondée sur le risque pour concevoir des systèmes de qualité pour les produits biologiques
Bien que les réglementations industrielles prévoient des exigences de fabrication très strictes que les sociétés doivent respecter, les différents produits biologiques sont tous fabriqués de manière différente, ce qui nécessite une approche du contrôle qualité fondée sur le risque à chaque étape de la chaîne de valeur. Le contrôle et la surveillance sont au coeur d'un contrôle qualité satisfaisant ; il faut garantir que les produits restent conformes aux spécifications à chaque étape de la production, ce qui permet aux fabricants de savoir s'il est nécessaire de prendre des mesures correctives, et garantir que les produits sont sûrs, efficaces et d'une qualité acceptable lorsqu'ils arrivent sur le marché.

Alors que la fabrication d'un médicament dérivé de substances chimiques peut comporter 40 à 50 tests critiques, cela peut aller jusqu'à 250 tests ou plus pour un produit biologique. (4) Dans la phase amont (culture cellulaire, fermentation), l'utilisation de techniques d'analyse solides pour le contrôle des matières premières garantit la grande qualité de celles-ci. La surveillance continue des paramètres essentiels comme la croissance cellulaire, les concentrations de substances nutritives et les métabolites permet des ajustements rapides, optimisant ainsi les conditions des cultures cellulaires. En outre, la mise en œuvre de tests en cours de fabrication, comme les tests de biomarqueurs, permet de détecter rapidement les écarts, garantissant ainsi l'homogénéité des produits.
Pour la phase aval (purification et raffinage du biomatériau obtenu), des techniques à haute résolution comme la chromatographie et la spectrométrie de masse peuvent améliorer la précision des processus de purification, garantissant l'élimination des impuretés et fournissant un produit d'une grande pureté. Des tests rigoureux portant sur les attributs de qualité du produit, comme l'activité et la stabilité, permettent de confirmer l'efficacité et la durée de conservation du produit biologique. En outre, l'utilisation d'analyses en temps réel permet des ajustements immédiats, optimisant ainsi l'efficacité des opérations en aval.
D'autres possibilités de test et des modifications de l'approche sont également nécessaires en fonction du type de produit biologique fabriqué.
Approches évolutives du contrôle et de l'assurance qualité dans un monde en mutation
Les tendances montrent que le marché mondial des produits biologiques devrait poursuivre son développement rapide au cours des prochaines années, les analystes prévoyant que sa valeur passera de 367,17 milliards de dollars en 2023 à plus de 620 milliards de dollars d'ici 2032. (5) Un des principaux défis de cette croissance est la préservation de l'équilibre entre l'offre et la demande, ce qui conduit les sociétés à investir dans l'augmentation de leurs capacités de production. La mise en place de voies d'examen et d'agrément accélérées pour les nouveaux produits biologiques exerce également une pression supplémentaire sur les fabricants pour qu'ils réduisent le délai de mise sur le marché de leurs produits.
Un des aspects des nouvelles technologies qui pourrait contribuer à augmenter les capacités et à accélérer la production est les logiciels de pointe qui utilisent l'intelligence artificielle (IA). En créant et en analysant des données, l'IA peut aider les fabricants à étudier leurs processus et à élaborer des systèmes plus durables et plus efficaces et à prévoir l'offre avec une plus grande précision. En créant une boucle de réaction efficace, les fabricants peuvent appliquer les enseignements tirés à chaque étape de la chaîne de valeur afin de se concentrer sur les domaines qui ont les plus fortes répercussions sur la qualité et le rendement des produits.
Le défi de l'augmentation de l'offre de produits biologiques est encore aggravé par la pénurie de personnel dans ce secteur, les fabricants s'efforçant de pourvoir les postes et de conserver le personnel expérimenté. Bien qu'il n'y ait pas de solution miracle pour résoudre ce problème, l'automatisation est de plus en plus considérée comme une solution potentielle pour surmonter les goulets d'étranglement immédiats, réduire la dépendance à l'égard du personnel spécialisé et éventuellement atténuer les contraintes de capacités. L'intégration de l'automatisation dans la fabrication de produits biologiques pourrait également permettre de réduire les erreurs humaines, d'éliminer les risques de contamination et de supprimer l'exposition aux matières dangereuses.
La progression des produits biologiques comme domaine vital de la médecine moderne est indéniable mais le maintien de la confiance dans ces produits thérapeutiques dépend de la vigilance combinée des organismes réglementaires et des fabricants, ainsi que de l'innovation continue d'outils plus puissants et plus homogènes pour soutenir les contrôles qualité dans un paysage en constante évolution. Grâce à cet esprit de collaboration, nous pourrons continuer à exploiter la puissance des produits biologiques pour offrir aux prescripteurs des options thérapeutiques transformatrices et améliorer les résultats pour leurs patients.
[1] International Alliance of Patient Organizations. Fact Sheet 2: Regulation of Biologics. Disponible sur : https://www.iapo.org.uk/sites/default/files/files/factsheet2.pdf Dernière consultation : février 2024.
[2] Agence européenne des médicaments. Biological guidelines webpage. Disponible sur : https://www.ema.europa.eu/en/human-regulatory-overview/research-and-development/scientific-guidelines/biological-guidelines Dernière consultation : février 2024.
[3] U.S. Food and Drug Administration. Biosimilars: Review and approval webpage. Disponible sur : https://www.fda.gov/drugs/biosimilars/review-and-approval Dernière consultation : février 2024.
[4] Morrow T, Felcone LH. Defining the difference: What Makes Biologics Unique. Biotechnol Healthc. 2004 Sep;1(4):24-9.
[5] Precedence Research. Biologics Market (By Source: Microbial, Mammalian, Others; By Product: MABs, Vaccines, Antisense, RNAi & Molecular Therapy, Recombinant Proteins, Others; By Indication: Oncology, Immunological Disorders, Cardiovascular Disorders, Hematological Disorders, Others; By Manufacturing: Outsourced, In-house; By Distribution Channel) - Global Industry Analysis, Size, Share, Growth, Trends, Regional Outlook, and Forecast 2023 – 2032. Disponible sur : https://www.precedenceresearch.com/biologics-market Dernière consultation : février 2024.
VOUS SEREZ PEUT-ÊTRE INTÉRESSÉS PAR CES ARTICLES...
PARTAGEZ CET ARTICLE :
- Pharmaceutical Quality Control